Os sistemas fotovoltaicos têm uma longa vida útil projetada, tipicamente, de 25 anos.
Para garantir a longevidade do projeto devemos estudar e garantir a durabilidade de todos os componentes individuais.
Um dos componentes mais críticos em relação à durabilidade e à segurança são as estruturas de fixação dos módulos fotovoltaicos.
De formas e aplicações variáveis, podemos encontrá-las instaladas de muitas maneiras diferentes, em vários tipos de ambientes e expostas a diversas intempéries. As estruturas podem falhar de diversas maneiras possíveis.
As principais causas de defeitos são a instalação incorreta, a negligência no cálculo de dimensionamento (especialmente por causa da carga de vento), escolhas inapropriadas do método de fixação, excesso de carga sobre a estrutura e corrosão do material.

Este artigo tem como objetivo mostrar quais as preocupações que o projetista e o instalador devem ter ao selecionar uma estrutura e o método de fixação em relação à durabilidade do material e à resistência a corrosão.
Corrosão bimetálica ou corrosão galvânica
Damos o nome de corrosão galvânica ao processo eletroquímico em que dois metais em contato iniciam um processo corrosão causado pela transferência de elétrons na presença de um eletrólito. Todas as ligas metálicas têm a elas associadas uma característica elétrica referente à facilidade com que o metal cede elétrons ao meio em que se encontra.
A facilidade de um metal em ceder elétrons denomina-se eletropositividade, enquanto a tendência de absorver elétrons denomina-se eletronegatividade. De acordo com a nomenclatura usada no campo da química, o material com maior eletronegatividade possui um maior potencial de redução.
Também se diz que o material mais eletropositivo possui maior reatividade, ou seja, um material é mais reativo do que outro (tem uma tendência maior a perder elétrons) quando apresenta maior eletropositividade.
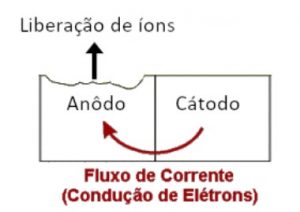
Quando um metal ou uma liga metálica entra em contato com outra liga com eletronegatividade diferente ocorre o aparecimento de um potencial elétrico entre os dois materiais. Com a adição de um eletrólito, que é um meio aquoso capaz de conduzir íons e elétrons, forma-se uma célula ou pilha galvânica.
Este é o mesmo princípio de funcionamento de uma pilha comum – dois metais distintos separados por um eletrólito. A célula galvânica faz uma corrente fluir do material mais eletropositivo (ânodo) para o material mais eletronegativo (cátodo).
A liga metálica anódica sofrerá corrosão, uma vez que o processo de doação de elétrons forma íons que podem se desprender do metal. Por exemplo, uma liga de ferro atuando como ânodo sofre a reação química abaixo:
Fe → Fe2+ + 2e
Essa reação retira o ferro da liga metálica e o disponibiliza na forma de íons de ferro para o eletrólito. O íon de ferro se combina com o oxigênio do ar e causa a ferrugem (óxido de ferro II e III principalmente). Enquanto isso, no cátodo, o metal recebe os elétrons cedidos pelo anodo.
A corrosão galvânica ocorre de forma significativa quando há uma diferença de eletronegatividade das ligas em contato maior do que 0,5V. A tabela abaixo mostra os valores de eletronegatividade relativa ao ouro das ligas metálicas mais comuns.
Tabela 1 – Valores de eletronegatividade de ligas comuns em relação ao ouro

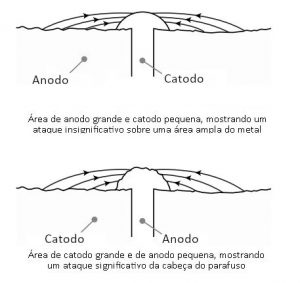


Caso um parafuso esteja em contato com outro material que o torne ânodo, o mesmo se corrói com rapidez, aumentando o risco de quebra e afrouxamento do aperto. Resumidamente, para que haja corrosão galvânica, é necessário que:
- Exista um eletrólito conectando os dois metais: o eletrólito no caso de estruturas expostas ao tempo são a água, a umidade do ar e a maresia;
- Contato elétrico entre os dois metais: caso haja um isolante entre os dois metais, não haverá caminho para a corrente galvânica fluir, portanto a corrosão galvânica não ocorre;
- Uma diferença de eletropositividade ou eletronegatividade maior do que 0,5 V.
Proteção contra corrosão galvânica
Existem medidas que podem ser adotadas para prevenir a corrosão galvânica de estruturas metálicas.
A primeira medida, que nem se é possível, é utilizar metais compatíveis entre si, ou seja, que têm diferença de eletronegatividade menor do que 0,5 V. Nem sempre é possível analisar previamente cada combinação de metal usada na estrutura a ser montada em campo no cliente.
Uma segunda medida pode ser a seleção de materiais tal que o ânodo tenha área muito maior do que o cátodo. Quando isso ocorre a corrosão é diminuída e pode tornar-se insignificante, dependendo da relação entre as áreas e da ausência de eletrólito (em regiões de clima seco, com pouca umidade no ar).
Caso não seja possível escolher materiais compatíveis, uma solução é garantir que as peças metálicas de uma estrutura tenham algum tratamento que evite a corrosão galvânica. Esse tratamento pode ser a adição de uma camada de zinco ao aço, a anodização do alumínio ou a realização de tratamentos de superfície especiais.
A camada de zinco do aço zincado ou aço galvanizado protege o aço do contato com o oxigênio e outra fontes de corrosão externas. O zinco ainda atua como ânodo de sacrifício caso haja um rompimento dessa barreira, cedendo elétrons para o aço e evitando que o mesmo se desintegre.

O local da instalação é um fator determinante para a durabilidade das estruturas galvanizadas. O local de instalação influencia diretamente a espessura da camada de zinco a ser aplicada.
A camada de zinco vai corroendo-se ao longo do tempo e pode expor o aço à corrosão se a espessura correta não for observada. A taxa de corrosão da camada de zinco depende diretamente do meio em que se encontra e do metal que o mesmo protege, conforme a tabela abaixo.
Tabela 2 – Corrosão estimada da camada protetora de zinco para cada tipo de metal em contato e ambiente de instalação, em micrômetros por ano

Na figura abaixo, vemos um exemplo de corrosão acentuada pela maresia em um local litorâneo. Na fotografia é mostrado especificamente um caso de corrosão bimetálica pelo contato de terminais de aterramento com a moldura do módulo fotovoltaico.
Normalmente, esses conectores são confeccionados em cobre, bronze (liga de estanho e cobre) ou latão (liga de cobre e zinco), que possuem maior eletronegatividade do que o alumínio. Sendo mais eletropositivo, o alumínio tende a desintegrar-se.

Em alguns casos é possível fazer outros tipos de tratamentos superficiais ou adotar estratégias para isolar as partes metálicas incompatíveis. Se os metais estiverem isolados entre si ou isolados em relação ao eletrólito, não há mais meios de o ânodo ceder elétrons ao cátodo.
Essa isolação pode ser química (com o tratamento superficial das peças) ou física (onde as partes metálicas estão afastadas por um isolante). A solução física nem sempre é viável, pois pode representar um aumento do custo da obra e da necessidade de manutenções mais frequentes a fim de se verificar a qualidade do isolamento.

As ligas de alumínio podem ser protegidas através do crescimento de uma camada adicional de óxido em sua superfície. O óxido que é formado atua como um isolante elétrico, diminuindo assim o fluxo de corrente e a corrosão bimetálica quando em contato com outra liga.
O alumínio tratado dessa maneira recebe o nome de alumínio anodizado. Por causa da sua boa durabilidade e compatibilidade, o alumínio anodizado é o material mais comum na construção das molduras dos módulos fotovoltaicos e nas estruturas de fixação.
Apesar de suas vantagens, o alumínio tem custo elevado e pode ser substituído com êxito em alguns casos pelo aço submetido a tratamentos superficiais anticorrosivos como a galvanização, a fosfatização e a pintura eletroforética.
A camada de proteção criada pelos tratamentos de superfície deve evitar que haja contato dos materiais pela presença do eletrólito, tipicamente formado por condensados, poeira, orvalhos, chuvas, resíduos úmidos em contato com os metais, umidade do solo e outros.
Com o isolamento entre os metais a pilha galvânica não é formada, interrompendo assim a troca de elétrons geração de íons e a corrosão galvânica. Um ponto importante nos tratamentos nas estruturas para sistemas fotovoltaicos é a proteção UV (ultravioleta) compatível com os demais componentes.
As estruturas estão expostas e portanto sujeitas a um fator de risco importante na definição da proteção à corrosão empregada. Os tratamentos superficiais mais comuns encontrados na indústria e que podem ser aplicados também no segmento fotovoltaico, além da tradicional galvanização, são a fosfatização e a eletroforese catódica.
A fosfatização é um tratamento superficial muito usado na indústria automobilística, que oferece uma boa proteção anticorrosão e boa aderência à pintura. A fosfatização é normalmente empregada como preparação para um tratamento superficial final, como é o caso da eletroforese catódica (KTL), que adiciona uma película de pigmentos orgânicos e confere às peças metálicas uma proteção extraordinária contra corrosão.

Corrosão em estruturas de solo e sistemas de aterramento
Todos os sistemas solares necessitam de aterramento. Em sistemas implementados no solo temos o metal da estrutura enterrado e a malha de aterramento, que são tipicamente de metais distintos, podendo sofrer corrosão entre si.
A malha de aterramento tipicamente é feita de cobre nu enterrado direto ao solo e a estrutura metálica enterrada tipicamente é de alumínio ou aço. Ambos os metais da estrutura formam pilhas galvânicas com o cobre, porém a relação entre as áreas dos metais é tal que a corrosão causada pela associação é pequena.
Para fins de fixação adicional e durabilidade, as ligas de aço comumente estão presas em sapatas de concreto enterradas. O concreto forma uma espécie de película no aço que diminui os efeitos de corrosão galvânica no material.
Isso não isenta a preocupação com a corrosão galvânica, pois as conexões com o sistema de aterramento ainda devem ser feitas com metais compatíveis. Os materiais também podem sofrer outros processos de corrosão relacionados à acidez e composição do solo.
Corrosão em sistemas fotovoltaicos
O projetista e instalador devem estar atentos no momento de selecionar a estrutura para um sistema fotovoltaico. A corrosão de estruturas nesses sistemas se dão principalmente por:
- Incompatibilidade entre os metais da estrutura, módulo e telhado;
- Escolha de parafusos incompatíveis. Por exemplo, parafuso de aço zincado em estrutura de aço inox;
- Danos à camada de anodização do alumínio ou do aço galvanizado;
- Metais inapropriados para localizações com maresia significativa.

Conclusão
A escolha adequada dos materiais para a construção de estruturas de fixação é um fator importante na determinação da vida útil dos sistemas fotovoltaicos. Parafusos, grampos de aterramento e partes estruturais devem ser escolhidos de acordo com a eletronegatividade de cada material.
Também se deve levar em conta o ambiente da instalação. Regiões oceânicas, com a presença forte de salinidade, podem apresentar corrosão acelerada dos materiais. Em todos os casos é importante verificar o tipo de tratamento empregado pelos fabricantes de estruturas, como o processo KTL (eletroforese catódica), o processo Geomet e outros.